ARTÍCULO ORIGINAL
Empleo de la técnica SPME-GC/MSD/FID como alternativas efectivas para la determinación de residuos de pesticidas organofosforados
Use of the SPME-GC/MS/FID technique as effective alternatives for the determination of organophosphorus pesticide residues
Dra. Beatriz E. Jaramillo-Colorado, Lic. Héctor Pertuz-Alandette, Lic. Flor M. Palacio-Herrera
Universidad de Cartagena, Facultad de Ciencias Exactas y Naturales, Campus San Pablo, Cartagena, Bolívar, Colombia.
RESUMEN
Los pesticidas organofosforados (OPs) están siendo ampliamente usados en la agricultura, ellos pueden causar efectos tóxicos en humanos y animales, generando numerosos problemas ambientales. Especialmente, a largo plazo, puede causar daños graves en los ecosistemas y sus personas asociadas. El objetivo de esta investigación fue determinar si la leche que se comercializa en la ciudad de Cartagena de Indias tiene concentraciones residuales de plaguicidas organofosforados. Se analizaron siete muestras de leche, seis tipos de leche pasteurizada de diferentes marcas y un tipo de leche cruda obtenida de una piara del municipio de María la Baja, Bolívar, Colombia. La técnica de extracción utilizada fue microextracción en fase sólida (SPME) en modo headspace (HS) y los métodos empleados para la separación e identificación de los compuestos fueron cromatografía de gases (GC) con detector de ionización de llama (FID) y detector de espectrometría de masas (MSD). Estos métodos reflejaron ser ventajosos debido a su solidez ambiental y facilidad en sus resultados precisos confirmados. Los compuestos organofosforados no se detectaron en las muestras de leche.
Palabras clave: leche, plaguicidas organofosforados, extracción, identificación, cuantificación.
ABSTRACT
Organophosphorus pesticides (OPs), are beingwidely used in agriculture, can cause toxic effects to humans and animals. The indiscriminate use of pesticides has generated numerous environmental problems. Especially, in the long term, it can cause serious harm in ecosystems and their associated individuals. The purpose of this investigation was to determine if the milk that is commercialized in the city of Cartagena de Indias has residual concentrations of organophosphorus pesticides. Seven milk samples were analyzed, e.g. six types of pasteurized milk of different brands and one type of raw milk obtained from a herd of the municipality of Maria la Baja, Bolívar, Colombia. The extraction technique used was solid phase microextraction (SPME) in headspace (HS) mode and the methods employed for separation and identification of the compounds were gas chromatography (GC) with flame ionization detector (FID) and mass spectrometry detector (MSD). This method proved advantageous in its application because of its environmentally soundness and facility in application and its confirmed accurate results. Organophosphorus compounds were not detected in the milk samples.
Keywords: Milk, organophosphorus Pesticides, Extraction, Identification, Quantification.
INTRODUCCIÓN
Dentro de la industria agrícola, los productos químicos sintéticos se utilizan para aumentar la calidad y el rendimiento de los cultivos. Uno de los tipos de productos químicos sintéticos son los pesticidas organofosforados (OPs) que ayudan a mantener los alimentos en excelentes condiciones atacando las plagas que dañan los cultivos. Después de descubrir que estos tipos de pesticidas son fácilmente degradables, se considera una solución más ecológica en comparación con los plaguicidas organoclorados que son más persistentes a pesar de que los PO poseen una mayor toxicidad aguda (Rodrigues et al., 2011). Los Organophosphates se caracterizan como el esteres ácido fosfórico y se usan como los insecticidas del espectro ancho en varias cosechas (Pagliuca et al., 2004).
Además, los organofosforados pueden actuar como compuestos neurotóxicos, ya que son inhibidores de la enzima colinesterasa, una enzima que es responsable del correcto funcionamiento del sistema nervioso (Fenik et al., 2011). El uso indiscriminado de pesticidas ha generado numerosos problemas ambientales, especialmente a largo plazo. La salud de todas las especies se pone en riesgo cuando se exponen diariamente a dosis desconocidas de estos posibles agresores. Teniendo en cuenta este gran problema, organizaciones como la Comisión del Codex Alimentarius (CODEX) han sido responsables de regular el uso de varios pesticidas en alimentos como la leche. Un método de control es establecer los niveles máximos de residuos (LMR) de plaguicidas para cada producto a fin de definir niveles aptos para el consumo humano. De esta forma, CODEX espera mitigar el efecto de estos pesticidas. Para hacer cumplir estas restricciones, los funcionarios deben tener los medios para evaluar los niveles de organofosforados en los cultivos. Este fue el punto de partida para los científicos analíticos de crear y buscar nuevos métodos de detección en productos que contienen pesticidas (Sang et al., 2013).
La leche de consumo estándar puede contaminarse con pesticidas a través de varias vías de exposición. Ya sea antes del procesamiento a través del consumo de alimentos contaminados con plaguicidas por la vaca, el pastoreo en suelos que han sido afectados por estos contaminantes o la aplicación directa a animales en establos. O durante el procesamiento en las industrias productoras de leche donde se aplican pesticidas para eliminar insectos a fin de garantizar la higiene del producto (Santaeufemia et al., 2006).
Los animales productores de leche expuestos a altas condiciones de plaguicidas pueden transferir una carga significativa de estos a su proceso metabólico, acumulándose en lípidos y lipoproteínas (Dagnac et al., 2009). Por lo tanto, las principales causas de la presencia de residuos de organofosforados en la leche son el uso excesivo y poco regulado de estos compuestos en las prácticas agrícolas para el control de plagas, y su particular propiedad fisicoquímica de la liposolubilidad.
A lo largo del tiempo se emplearon diferentes métodos de preparación de muestras como: extracción líquida líquida (LLE), extracción en fase sólida (SPE), extracción dispersiva en fase(González et al., 2005; Xu et al., 2016). Los diferentes métodos de análisis se desarrollaron con el objetivo de cuantificar los residuos de plaguicidas en la leche, principalmente basados en técnicas cromatográficas (Nunez et al., 2005; Gomes et al., 2013).
Los procedimientos analíticos estándar para detectar residuos de OP en muestras consisten en el uso de compuestos químicos altamente tóxicos o solventes muy volátiles para el tratamiento de la muestra (Tobiszewski et al., 2009; Armenta y de la Guardia, 2016). La Cromatografía de gases (espacio para la cabeza) (GC-HS) se considera una técnica analítica "verde", ya que es un poco ecológica. Las ventajas de su uso son: (i) reducción de las placas analíticas, (ii) eliminación de disolventes y reactivos, (iii) uso de temperaturas relativamente bajas, (iv) análisis sencillo y rápido, y (v) aplicación a líquidos y muestras sólidas. Los sistemas dinámicos y estáticos se pueden usar junto con técnicas de desorción como la microextracción en fase sólida (SPME) la cual se utiliza en el análisis de contaminantes ambientales en una gran variedad de matrices: aire, agua, suelo y sedimentos. De igual forma resulta muy útil para la identificación de sustancias químicas tales como: contaminantes orgánicos volátiles (COV), SVOC, plaguicidas, herbicidas, compuestos organometálicos y aminas. Esta técnica de preparación de muestras es ventajosa en comparación con otras porque no requiere ningún tipo de solvente y también permite combinar el muestreo, el aislamiento del analito y el enriquecimiento en un solo paso. Está compuesto por una fibra recubierta con un solvente sólido o un polímero líquido dependiendo del formato de exposición de la muestra (Dagnac et al., 2009; Armenta y de la Guardia, 2016; Xu et al., 2016).
Mediante la técnica SPME, es posible analizar varias matrices complejas, incluidas muestras ambientales, biológicas y de alimentos, como confirmaron (Lin et al., 2016). En el análisis de residuos de plaguicidas, SPME también permitió la determinación de diferentes clases de plaguicidas, como organofosforados, organoclorados y piretroides, en numerosos tipos de matrices como orina de vino, suero, muestras de líquidos ambientales y leche (Rodrigues et al., 2011; Gomes et al., 2013).
El objetivo de esta investigación fue identificar y determinar residuos de plaguicidas organofosforados en leche de vaca procesada y comercializada en la ciudad de Cartagena de Indias. El empleo de la técnica de extracción utilizada fue microextracción en fase sólida (SPME) en modo headspace (HS) y los métodos empleados para la separación e identificación de los compuestos fueron cromatografía de gases (GC) con detector de ionización de llama (FID) y detector de espectrometría de masas (MSD).
MÉTODOS
Reactivos: Las soluciones estándar disulfoton, chlorpyrifos y Diazinon se adquirieron de Fluka Analítica (Alemania). Los disolventes Acetona y n-Hexano eran de grado analítico (Panreac, EE. UU.). Se usó una solución de 500 μg / ml disuelta en acetona: Hexano (2: 8), para cada uno de los pesticidas evaluados. Todas las soluciones de compuestos organofosforados fueron protegidas de la luz y almacenadas a bajas temperaturas antes del uso.
Condiciones Cromatográficas: los análisis se realizaron usando un sistema cromatográfico GC/FID (Agilent 4890), en modo splitless y una columna capilar. (HP-5 30m x 0.32mm ID x 0.25 μm). El helio se usó como gas de arrastre. La temperatura inicial fue de 60 °C durante 2 minutos, con una velocidad de calentamiento de 15 °C/min hasta 160 °C, mantenida durante 6 minutos, y una velocidad de calentamiento de 20 °C/min a 280 °C, mantenida durante 10 minutos. La temperatura del detector era de 300ºC.
El procedimiento de microextracción en fase sólida (HS-SPME) se llevó a cabo utilizando una fibra de polidimetilsiloxano-divinilbenceno (PDMS-DVB) de 65 μm, marca Supelco (North Harrison road, Bellefonte PA).
El análisis cualitativo y cuantitativo se realizó utilizando patrones estándar de compuestos organofosforados.
El análisis de Cromatografía de Gases acoplado a Espectrometría de masas (GC-MS) se llevó a cabo utilizando un cromatógrafo de gases Agilent Technologies 7890A Network GC (Palo Alto, California, EE. UU.) Acoplado a un detector selectivo de masas (MSD) Agilent Technologies 5975 GC-MS, equipado con un inyector automático Agilent 4513A. La columna utilizada fue una columna capilar HP-5MS (30m x0.2 5mm id) recubierta con 5% difenil-95% polidimetilsiloxano (0,25 μm de espesor de fase) (J & W Scientific, EE. UU.), El gas portador era helio (grado de calidad 5,0 a 99,99%) a 87 kPa (1,17 ml / min); el modo de inyección fue splitless, el volumen de muestra inyectado fue de 1 μL. Los espectros de masas se obtuvieron mediante ionización por impacto de electrones (EI, 70 eV). Las temperaturas de la cámara de ionización y la línea de transferencia fueron de 230 °C y 300 °C, respectivamente, y el rango de masa de adquisición fue de 50-500 m/z.
Muestras de leche: Las muestras se tomaron de bolsas de leche pasteurizada, que se compraron en supermercados de cadena en la ciudad en febrero de 2016 y se almacenaron a bajas temperaturas (4 °C) hasta que se analizaron. Las muestras de leche no tratadas se tomaron de las fincas del municipio de María la Baja, que se almacenaron en botellas de vidrio y se colocaron en cajas de hielo, y luego se transportaron al laboratorio para su posterior análisis.
Tiempo de exposición a la fibra: Con el objetivo de optimizar el tiempo adecuado para la extracción de los plaguicidas, se realizó una validación del tiempo de exposición de la fibra de polidimetilsiloxano-divinilbenceno, con tiempos de 15, 30, 45 y 60 minutos (Rodrigues et al., 2011).
Procedimiento de extracción de micro en fase sólida: La etapa de extracción se realizó colocando 12 ml de leche en un vial ámbar con un tapón de rosca y un tabique de silicona de 20 ml. La muestra de leche se calentó posteriormente a 90 °C con agitación a 600 rpm. A continuación, la fibra de polidimetilsiloxano-divinilbenceno previamente activada se transfirió a través del tabique del vial, en el espacio de la cabeza, para exponerla a la muestra de leche durante 45 minutos. Después de este tiempo, la fibra se retiró del vial y los compuestos extraídos en la fibra se desorbieron térmicamente en el puerto de inyección del cromatógrafo de gases durante 5 minutos (Rodrigues et al., 2011).
Preparación de las muestras para validación: como referencia para la validación del método analítico, se siguieron las guías de validación del Ministerio de Salud de Costa Rica (Ministerio de Salud Pública de Costa Rica, 1998).
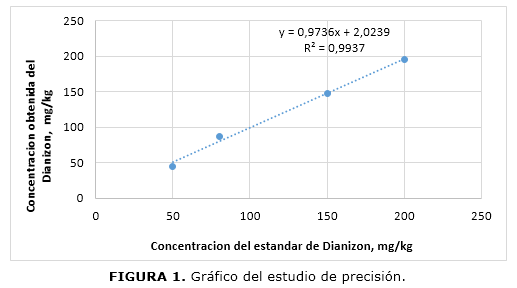
Para evaluar los parámetros de linealidad, precisión y exactitud, se prepararon 9 concentraciones de diazinón por duplicado en el rango de 50 a 200 mg/kg. La linealidad del método se realizó mediante regresión lineal. Se analizaron tres diluciones del estándar por triplicado para el cálculo. Se usaron estándares externos para la cuantificación de las diferentes muestras de leche.
DISCUSIÓN DE RESULTADOS
Después del análisis de los datos por medio de la validación del método, se demostró una respuesta lineal en el rango de 50 a 200 mg/kg. El coeficiente de correlación fue mayor a 0,99, por tanto existe una relación lineal entre las variables notoriamente fuertes ya que el valor se encuentra muy cercano a 1. (Figura 1).
La precisión se evaluó mediante doce determinaciones con cuatro niveles de concentración 50, 100, 150 y 200 mg / kg. Los resultados obtenidos se muestran en la Tabla 1. Los valores de la desviación estándar relativa fueron menores al 2%, lo que confirma la precisión del método analítico.
En la Tabla 2, se presenta el porcentaje de recuperación del Dianizon a distintas concentraciones, demostrando altas recuperaciones para cada uno de los valores evaluados (FAO/OMS, 2010).
La Tabla 3 muestra el nivel mínimo de detección (NMD) y el nivel mínimo de cuantificación (NMC) para los plaguicidas organofosforados evaluados en leche.Siendo el Dianizon el compuesto con el NMD más bajo junto con su NMC en comparación con el Disulfoton y el clorpirifos que se encuentran en igualdad de valores.
La Figura 2 muestra las áreas totales para cada OPs, realizando una relación con los tiempos de exposición. Demostrando que el pesticida que obtuvo mayor área en cada uno de los tiempos determinados fue el Dianizon, además se puede apreciar el aumento de las áreas a medida que incrementa el tiempo.
En la Figura 3 se presenta las curvas de calibración de los tres patrones de OPs (disulfoton, Diazinon, Clorpirifos), trabajados a cinco concentraciones diferentes.
Después de analizar las diferentes muestras de leche, los resultados muestran que no hubo presencia de plaguicidas organofosforados (Tabla 4). El método desarrollado en esta investigación utilizó cromatografía de gases acoplada a un detector de ionización de llama (FID) y confirmada con el detector de espectrometría de masas (MSD), se considera el detector universal, con el cual no se encontraron organofosforados (Figura 4 y 5).
Diversos análisis han trabajado la presencia de pesticidas organofosforados en los alimentos obteniéndose como resultado la detección de residuos en altas y bajas concentraciones; entre estos estudios encontramos la determinación de residuos de plaguicidas en la cadena alimenticia de la leche de ganado, centrándose principalmente en la presencia de plaguicidas organoclorados debido a su alta persistencia y liposolubilidad (Selvi et al., 2012). Sin embargo, su progresivo desuso en favor de los compuestos organofosforados ha llevado a que se realicen estudios sobre el contenido residual de compuestos organofosforados (Santaeufemia et al., 2006a; Rodrigues et al., 2011).
Generando la necesidad de metodologías de análisis químicos para detectar la presencia de ciertos contaminantes. Al considerar los niveles bajos que caracterizan las concentraciones máximas permitidas reportadas para plaguicidas organofosforados en la leche, se debe enfatizar que las metodologías de análisis químico dirigidas a la detección y cuantificación de estos pesticidas deben ser capaces de proporcionar altas tasas de recuperación y bajos límites de detección (LeDoux, 2011).
Metodologías como las de HS-SPME, permite analizar residuos de OPs en leche de vaca, dando como resultados en condiciones estandarizadas límites de detección y cuantificación oscilados entre 2,16 μg L - 1 y 6,55 μg L - 1 para etion a 10,9 μg L - 1 y 32,9 μg L - 1 para Methyl Paration. Luego del uso del método planteado se detectó clorpirifos y residuos de etión en muestras de leche no procesada. Este procedimiento demostró ser óptimo para la determinación de pesticidas además que resulta a bajo costo y evita la utilización de solventes en el transcurso de la extracción de la muestra, convirtiéndose en una alternativa amigable con el ambiente (Rodrigues et al., 2011).
En la investigación luego de realizar los análisis pertinentes a cada una de las muestras, no se les halló trazas de ningún tipo pesticidas, por lo cual se realizó un dopado con tres pesticidas organofosforados (Diazinon, Disulfoton y Clorpirifos) a las muestras de leche con la finalidad de comprobar la eficiencia La técnica microextracción en fase sólida (SPME) en modo headspace (HS) y de los métodos de cromatografía de gases (GC) con detector de ionización de llama (FID) y detector de espectrometría de masas (MSD). Las cuales arrojaron excelentes resultados comprobados mediante la validación del método y además por el perfil cromatográfico generado por el equipo haciendo visible la presencia de los patrones utilizados.
La principal causa de la presencia de residuos de plaguicidas organofosforados en la leche es su propiedad fisicoquímica de la liposolubilidad. Además, el uso excesivo y mal regulado de estos compuestos en las prácticas agrícolas para el control de enfermedades de los animales, transmitidas por insectos y parásitos.
Los estudios que analizaron 242 muestras de leche, realizadas en Galicia, España, encontraron la presencia de diclorvos, cumafos y metilparatión por debajo del límite máximo residual (LMR) establecido por la FAO (Santaeufemia et al., 2006; FAO/OMS, 2010).
La toxicidad de estos compuestos, incluso en pequeñas cantidades, puede desencadenar una gama de efectos agudos a crónicos. Varios efectos han sido confirmados por diferentes estudios (Gazzotti et al., 2009); (Pagliuca et al., 2004). Los investigadores han presentado la clara necesidad de establecer mecanismos de control y monitoreo con respecto a la contaminación de fósforo orgánico presente en la leche para el consumo humano (Morales Vallecilla et al., 2010; Shaker y Elsharkawy, 2015). La necesidad de metodologías de análisis químicos para detectar la presencia de estos contaminantes es una parte fundamental de estos mecanismos. Al considerar los niveles bajos que caracterizan las concentraciones máximas permitidas reportadas para plaguicidas organofosforados en la leche, se debe enfatizar que las metodologías de análisis químico dirigidas a la detección y cuantificación de estos pesticidas deben ser capaces de proporcionar altas tasas de recuperación y bajos límites de detección (LeDoux, 2011).
CONCLUSIONES
El método analítico desarrollado en esta investigación no detectó la presencia de compuestos organofosforados (diazinón, diclorvos, clorpirifos) en ninguna de las muestras de leche evaluadas en la ciudad de Cartagena de Indias.
El método desarrollado demostró ser viable por su bajo costo, además de ser rápido y partidista con el medio ambiente, ya que no utiliza un solvente en la etapa de extracción.
La precisión del método es adecuada y está por debajo de la especificada como criterio de aceptación (desviación estándar relativa ≤ 2%). Con base en los resultados obtenidos de la validación, se concluye que este método analítico utilizado para la determinación de organofosfatos en la leche es un método confiable.
AGRADECIMIENTOS
A la Universidad de Cartagena y Colciencias por contribuciones en el financiamiento o realización de esta investigación.
NOTA
La mención de marcas comerciales de equipos, instrumentos o materiales específicos obedece a propósitos de identificación, no existiendo ningún compromiso promocional con relación a los mismos, ni por los autores ni por el editor.
REFERENCIAS BIBLIOGRÁFICAS
ARMENTA, S.; DE LA GUARDIA, M.: “Green chromatography for the analysis of foods of animal origin”, TrAC Trends in Analytical Chemistry, 80: 517–530, 2016, DOI: https://doi.org/10.1016/j.trac.2015.06.012.
DAGNAC, T.; GARCIA-CHAO, M.; PULLEIRO, P.; GARCIA-JARES, C.; LLOMPART, M.: “Dispersive solid-phase extraction followed by liquid chromatography–tandem mass spectrometry for the multi-residue analysis of pesticides in raw bovine milk”, Journal of chromatography A, 1216(18): 3702–3709, 2009, DOI: https://doi.org/10.1016/j.chroma.2009.02.048.
FAO/OMS: Codex Alimentarius International Food Standard, [en línea], 2010, Disponible en: http://www.fao.org/fao-who-codexalimentarius/en/, [Consulta: 28 de agosto de 2016].
FENIK, J.; TANKIEWICZ, M.; BIZIUK, M.: “Properties and determination of pesticides in fruits and vegetables”, TrAC Trends in Analytical Chemistry, 30(6): 814–826, 2011, DOI: http://dx.doi.org/10.1016/j.trac.2011.02.008.
GAZZOTTI, T.; STICCA, P.; ZIRONI, E.; LUGOBONI, B.; SERRAINO, A.; PAGLIUCA, G.: “Determination of 15 organophosphorus pesticides in Italian raw milk”, Bulletin of environmental contamination and toxicology, 82(2): 251–254, 2009, DOI: http://dx.doi.org/10.1007/s00128-008-9609-0.
GOMES, M.J.; AMAYA, C.A.; WALISZEWSKI, S. M.; COLÍN, S.A.; F. M.M. GARCÍA: “Review Extraction and clean-up methods for organochlorine pesticides determination in milk”, Chemosphere, 92: 233–246, 2013, DOI: http://dx.doi.org/10.1016/j.chemosphere.2013.04.008.
GONZÁLEZ, R.M.J.; LIÉBANAS, F.A.; FRENICH, A.G.; VIDAL, J.M.; LÓPEZ, F.S.: “Determination of pesticides and some metabolites in different kinds of milk by solid-phase microextraction and low-pressure gas chromatography-tandem mass spectrometry”, Analytical and bioanalytical chemistry, 382(1): 164–172, 2005, DOI: http://dx.doi.org/10.1007/s00216-005-3144-1.
LEDOUX, M.: “Analytical methods applied to the determination of pesticide residues in foods of animal origin. A review of the past two decades”, Journal of chromatography A, 1218(8): 1021–1036, 2011, DOI: https://doi.org/10.1016/j.chroma.2010.12.097.
LIN, W.; WEI, S.; JIANG, R.; ZHU, F.; OUYANG, G.: “Calibration of the complex matrix effects on the sampling of polycyclic aromatic hydrocarbons in milk samples using solid phase microextraction”, Analytica chimica acta, 933: 117–123, 2016, DOI: https://doi.org/10.1016/j.aca.2016.05.045.
MINISTERIO DE SALUD PÚBLICA DE COSTA RICA: “Guia de validación para metodos analiticos”, 1998, Disponible en: https://www.ministeriodesalud.go.cr/index.php/biblioteca-de-archivos/2472-guia-de-validacion-de-metodos-analiticos.
NUNEZ, O.; MOYANO, E.; GALCERAN, M.T.: “LC–MS/MS analysis of organic toxics in food”, TrAC Trends in Analytical Chemistry, 24(7): 683–703, 2005, DOI: https://doi.org/10.1016/j.trac.2005.04.012.
PAGLIUCA, G.; GAZZOTTI, T.; ZIRONI, E.; PAVONCELLI, N.; ROSMINI, R.: “Proposal of an analytical method for determination of residues of organophosphorus pesticides in milk by GLC-NPD”, Veterinary research communications, 28(1): 257–259, 2004, DOI: https://doi.org/10.1023/B:VERC.0000045420.62584.2c.
RODRIGUES, F. de M.; MESQUITA, P.R.; DE OLIVEIRA, L.S.; DE OLIVEIRA, F.S.; MENEZES FILHO, A.; PEREIRA, P.A. de P.; DE ANDRADE, J.B.: “Development of a headspace solid-phase microextraction/gas chromatography–mass spectrometry method for determination of organophosphorus pesticide residues in cow milk”, Microchemical Journal, 98(1): 56–61, 2011, DOI: http://dx.doi.org/10.1016/j.microc.2010.11.002.
SANG, Z.-Y.; WANG, Y.-T.; TSOI, Y.-K.; LEUNG, K.S.-Y.: “CODEX-compliant eleven organophosphorus pesticides screening in multiple commodities using headspace-solid phase microextraction-gas chromatography–mass spectrometry”, Food chemistry, 136(2): 710–717, 2013, DOI: https://doi.org/10.1016/j.foodchem.2012.08.060.
SANTAEUFEMIA, M.; MELGAR, M.J.; CEPEDA, A.; GARCÍA, M.A.: “Estudio de la contaminación por plaguicidas organofosforados y triazinas en leche procedente de diversas rutas de recogida”, Revista de Toxicología, 23(1): 7–10, 2006.
SELVI, C.; PARAMASIVAM, M.; RAJATHI, D.S.; CHANDRASEKARAN, S.: “Multiresidue analysis of organochlorine pesticides in milk, egg and meat by GC–ECD and confirmation by GC–MS”, Bulletin of environmental contamination and toxicology, 89(5): 1051–1056, 2012, DOI: https://doi.org/10.1007/s00128-012-0789-2.
SHAKER, E.M.; ELSHARKAWY, E.E.: “Organochlorine and organophosphorus pesticide residues in raw buffalo milk from agroindustrial areas in Assiut, Egypt”, Environmental toxicology and pharmacology, 39(1): 433–440, 2015, DOI: https://doi.org/10.1016/j.etap.2014.12.005.
TOBISZEWSKI, M.; MECHLINSKA, A.; ZYGMUNT, B.; NAMIESNIK, J.: “Green analytical chemistry in sample preparation for determination of trace organic pollutants”, TrAC Trends in Analytical Chemistry, 28(8): 943–951, 2009, DOI: https://doi.org/10.1016/j.trac.2009.06.001.
VALLECILLA, C.; RODRÍGUEZ, N.; RESTREPO, L.F.; LÓPEZ, C.: “Relación entre residuos de clorpirifos en leche y sangre de vacas Holstein y niveles séricos de estradiol y tiroxina”, Revista Electrónica de Veterinaria. REDVET, 11(1): 1–22, 2010, ISSN: 1695-7504.
XU, C.-H.; CHEN, G.-S.; XIONG, Z.-H.; FAN, Y.-X.; WANG, X.-C.; LIU, Y.: “Applications of solid-phase microextraction in food analysis”, TrAC Trends in Analytical Chemistry, 80: 12–29, 2016, DOI: https://doi.org/10.1016/j.trac.2016.02.022.
Recibido: 13/11/2017
Aceptado: 14/03/2018
Dra. Beatriz E. Jaramillo-Colorado,Universidad de Cartagena, Facultad de Ciencias Exactas y Naturales, Campus San Pablo, Cartagena, Bolívar, Colombia. E-mail: bjaramilloc@unicartagena.edu.co